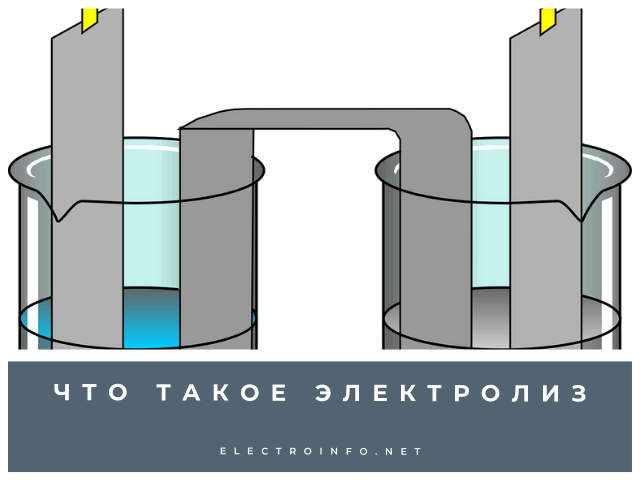
Электролизом называется химический процесс при постоянном токе, заставляющий перемещаться ионы в требуемом направлении. Этот процесс нашел применение в многих отраслях промышленности – химической, металлургической и других. Любой раствор состоит из частиц, которые имеют положительный и отрицательный заряды.
Такое состояние является нестабильным, так как противоположные заряды притягиваются. Таким образом появляется частица с нейтральным зарядом или другими словами новая молекула другого вещества. В статье будет описан механизм электролиза, как он происходит, работает, в каких сферах он нашел применение.
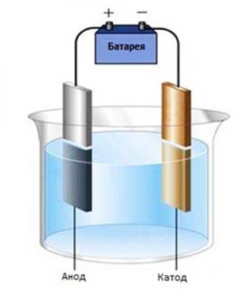
В чём заключается процесс
Для организации процесса перемещения ионов в растворе нужно только два электрода и источник тока. Положительно заряженный электрод, называемый анодом, способствует окислению анионов, то есть отрицательно заряженных частиц, а также нейтральных молекул. Катод, то есть отрицательно заряженный электрод, притягивает к себе положительно заряженные ионы и нейтральные молекулы.
Особенности процессов, происходящих на катоде, заключаются в том, что здесь восстанавливаются обычно сильные окислители. Таким образом, с помощью двух пластинок с разницей потенциалов, помещённых в электролит, можно получать новые вещества, менять состояние электродов и раствора.
Для чего он нужен
Электролиз широко применяется для осуществления следующих процессов:
- Получение веществ в чистом состоянии.Этот процесс используется для того, чтобы обработать горные породы и получить чистые вещества. Так образуются алюминий, двуокись марганца, водород, перекись водорода.
- Очистка сточных вод.В результате помещения в такие растворы электролитов происходит не только обеззараживание воды, но и образование взвесей, которые выпадают в осадок.
- Нанесение тонких покрытий.Под воздействием тока ионы металла осаждаются на предмете, формируя тонкую декоративную или защитную плёнку.
Этот список на самом деле гораздо обширней, поскольку с помощью разницы потенциалов можно с минимальными затратами добиваться значительного эффекта для разных целей.
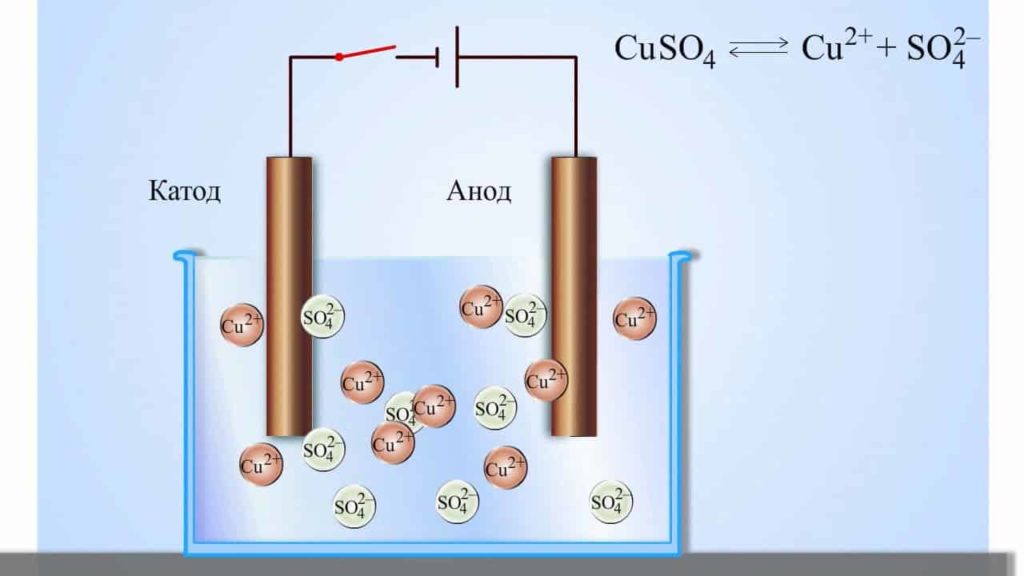
Правила электролиза водных растворов
Электролиз на катоде зависит только от положения металла в электрохимическом ряду напряжений:
- если катион электролита стоит левее алюминия (включительно), на катоде восстанавливается вода с выделением водорода, а катионы металла остаются в растворе:
2H2O+2e–= H2↑+2OH– (Li…Al) - если катион электролита стоит между алюминием и водородом, на катоде восстанавливаются и вода, и катионы металла;
Men++ne–= Me; 2H2O+2e– = H2↑+2OH– (Mn…Pb) - если катион электролита стоит правее водорода, на катоде восстанавливается только катионы металла:
Men++ne–= Me (Cu…Au) - если в растворе электролита находится несколько металлов, первыми восстанавливаются катионы металла, который в ряду напряжений стоит правее остальных.
- Электролиз на анодезависит только от материала, из которого изготовлен анод:
- в случае растворимого анода (металлы, которые окисляются в процессе электролиза – железо, медь, цинк, серебро) – всегда идет процесс окисления металла анода:
Me-ne–= Men+ - в случае нерастворимого анода (золото, платина, графит):
- идет процесс окисления аниона при электролизе растворов солей бескислородных кислот, за исключением фторидов:
Acm-me–= Ac - идет процесс окисления воды в остальных случаях (электролиз оксикислот и фторидов) – анион остается в растворе:
2H2O-4e–= 4H++O2↑ - при электролизе растворов щелочей окисляются гидроксид-ионы:
4OH–-4e–= 2H2O+O2↑
- идет процесс окисления аниона при электролизе растворов солей бескислородных кислот, за исключением фторидов:
- восстановительная активность анионов уменьшается в ряду (соответственно увеличивается способность окисляться):
- I–; Br–; S2-; Cl–; OH–; SO42-; NO3–; F–
- в случае растворимого анода (металлы, которые окисляются в процессе электролиза – железо, медь, цинк, серебро) – всегда идет процесс окисления металла анода:
Промышленное применение электролиза
Электролиз широко используется в следующих сферах промышленности:
- Выделение и очистка металлов.
- Получение алюминия, магния, натрия, кадмия.
- Получение щелочей, хлора, водорода.
- Очистка меди, никеля, свинца.
- Процессы напыления защитных покрытий с целью защиты металлов от коррозии.лектролиз (от греч. «лизис» – разложение, растворение, распад) – это совокупность физико-химических явлений на находящихся в жидкости электродах при прохождении электрического тока. Например, погрузив в воду два электрода и подключив их к источнику постоянного тока, мы обнаружим, что вокруг электродов выделяются пузырьки – это газы водород и кислород. При их образовании уменьшается масса воды, то есть она разлагается на входящие в её состав элементы.
Если электроды погружать не в воду, а в растворы или расплавы солей, кислот и щелочей, то можно наблюдать выделение других газов и даже твёрдых веществ, оседающих на поверхности электродов. По этой причине электролиз широко применяют в технике. Рассмотрим самые важные направления его применения. Но перед этим запомним, что электрод, присоединяемый к «+» источника тока, называют анодом, а электрод, присоединяемый к «–» источника тока, называют катодом.

Электрометаллургия
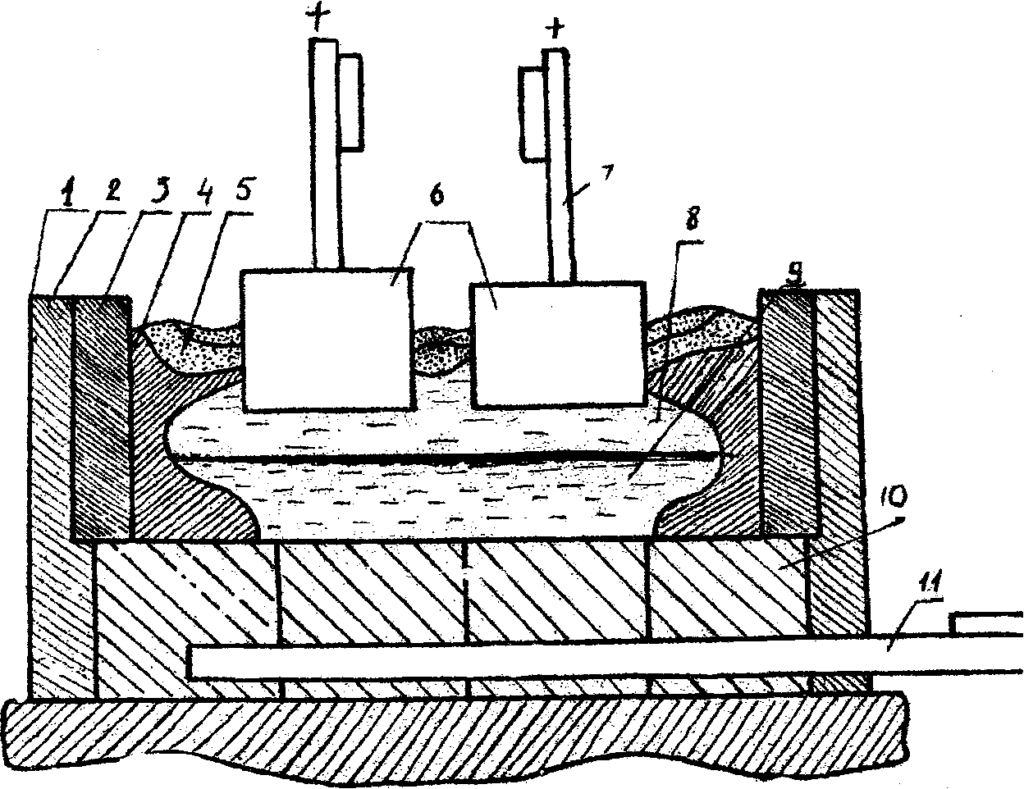
Электролитическим путём в промышленности получают многие металлы: алюминий, медь, магний, хром, титан и др. Например, для получения чистого алюминия в специальную металлическую ванну вливают расплавленную при 900 °С руду, содержащую алюминий в химически связанном виде (обычно в виде оксидов). В ванну опускают угольные стержни, которые служат анодами, а сама ванна – катодом. При прохождении тока через расплав на дне ванны выделяется жидкий алюминий, который сливают через отверстие внизу ванны.

Рафинирование (очистка) меди
Медь, применяемая в электро- и радиотехнике для изготовления проводников, должна быть чистой, поскольку примеси уменьшают электропроводность. Для очистки меди от примесей в электролитическую ванну заливают раствор сульфата меди II (устаревшее название – медный купорос) и опускают две пластины: анод – толстую пластину из неочищенной меди и катод – тонкий лист из чистой меди.
[stextbox id=’info’]При пропускании электрического тока анод постепенно растворяется, примеси выпадают в осадок, а на катоде оседает чистая медь. Аналогичным способом получают и другие чистые металлы – никель, свинец, золото.[/stextbox]
Гальваностегия
Для придания изделиям красивого внешнего вида, прочности или для предохранения от коррозии, их покрывают тонким слоем какого-либо металла: никеля, хрома и др. Для этого изделие тщательно очищают, обезжиривают и помещают как катод в электролитическую ванну, содержащую соль того металла, которым желают покрыть. Для более равномерного покрытия полезно применять две пластины в качестве анода, помещая изделие между ними.

Гальванопластика
Это электролитическое осаждение металла на поверхности какого-либо предмета для воспроизведения его формы. Для этого с предмета сначала снимают слепок (из воска или гипса) и покрывают его токопроводящим слоем, например, слоем графита. Подготовленный таким способом предмет помещают в качестве катода в ванну с раствором соли соответствующего металла. При включении тока металл из электролита оседает на поверхности предмета. Гальванопластику используют для изготовления неограниченного числа точных копий того изделия, с которого был снят слепок.
Интересное по теме: Что такое закон Ома
Гальванополировка
Если резное металлическое изделие поместить в раствор электролита и включить ток, то наиболее сильное электрическое поле образуется у микроскопических выступов на поверхности этого изделия. Если оно подключено к «+» источника тока, то наиболее интенсивно ионы металла будут «вырываться» именно из выступов, и поверхность металла выровняется.
Электрофорез
От греч. «форезис» – перенесение), это лечебная процедура. Электроды накладывают на тело человека. Между телом и электродом помещают бумагу или ткань, пропитанную электропроводящим лекарственным препаратом. При включении тока начинается движение заряженных частиц из бумаги или ткани в кожу, а затем в тело человека. Так происходит процесс ввода лекарств, скорость которого можно регулировать, изменяя силу тока. Электролиз применяют также и для синтеза различных неорганических и органических веществ; это изучается в отдельной науке – электрохимии.
Процессы, протекающие при электролизе
Электролиз получил широкое распространение в металлургии цветных металлов и в ряде химических производств. Такие металлы, как алюминий, цинк, магний, получают главным образом путем электролиза. Кроме того, электролиз используется для рафинирования (очистки) меди, никеля, свинца, а также для получения водорода, кислорода, хлора и ряда других химических веществ.
Сущность электролиза заключается в выделении из электролита при протекании через электролитическую ванну постоянного тока частиц вещества и осаждении их на погруженных в ванну электродах (электроэкстракция) или в переносе веществ с одного электрода через электролит на другой (электролитическое рафинирование). В обоих случаях цель процессов – получение возможно более чистых незагрязненных примесями веществ.
[stextbox id=’info’]В отличие от электронной электропроводности металлов в электролитах (растворах солей, кислот и оснований в воде и в некоторых других растворителях, а также в расплавленных соединениях) наблюдается ионная электропроводность.[/stextbox]
Электролиты являются проводниками второго рода. В этих растворах и расплавах имеет место электролитическая диссоциация – распад на положительно и отрицательно заряженные ионы. Если в сосуд с электролитом – электролизер поместить электроды, присоединенные к электрическому источнику энергии, то в нем начнет протекать ионный ток, причем положительно заряженные ионы – катионы будут двигаться к катоду (это в основном металлы и водород), а отрицательно заряженные ионы – анионы (хлор, кислород) – к аноду.

У анода анионы отдают свой заряд и превращаются в нейтральные частицы, оседающие на электроде. У катода катионы отбирают электроны у электрода и также нейтрализуются, оседая на нем, причем выделяющиеся на электродах газы в виде пузырьков поднимаются кверху. Электрический ток во внешней цепи представляет собой движение электронов от анода к катоду (рис. 1). При этом раствор обедняется, и для поддержания непрерывности процесса электролиза приходится его обогащать. Так осуществляют извлечение тех или иных веществ из электролита (электроэкстракцию).
Если же анод может растворяться в электролите по мере обеднения последнего, то частицы его, растворяясь в электролите, приобретают положительный заряд и направляются к катоду, на котором осаждаются, тем самым осуществляется перенос материала с анода на катод. Так как при этом процесс ведут так, чтобы содержащиеся в металле анода примеси не переносились на катод, такой процесс называется электролитическим рафинированием.
Если электрод поместить в раствор с ионами того же вещества, из которого он изготовлен, то при некотором потенциале между электродом и раствором не происходит ни растворения электрода, ни осаждения на нем вещества из раствора. Такой потенциал называется нормальным потенциалом вещества. Если на электрод подать более отрицательный потенциал, то на нем начнется выделение вещества (катодный процесс), если же более положительный, то начнется его растворение (анодный процесс).
Значение нормальных потенциалов зависит от концентрации ионов и температуры. Принято считать нормальный потенциал водорода за нуль. Если в электролите имеются ионы разных металлов, то первыми на катоде выделяются ионы, имеющие меньший отрицательный нормальный потенциал (медь, серебро, свинец, никель), щелочноземельные металлы выделить труднее всего. Кроме того, в водных растворах всегда имеются ионы водорода, которые будут выделяться ранее, чем все металлы, имеющие отрицательный нормальный потенциал, поэтому при электролизе последних значительная или даже большая часть энергии затрачивается на выделение водорода.
Путем специальных мер можно воспрепятствовать в известных пределах выделению водорода, однако металлы с нормальным потенциалом меньше 1 В (например, магний, алюминий, щелочноземельные металлы) получить электролизом из водного раствора не удается. Их получают разложением расплавленных солей этих металлов. Нормальные электродные потенциалы веществ, указанные в табл. 1, являются минимальными, при них начинается процесс электролиза, практически требуются большие значения потенциала для развития процесса.
[stextbox id=’warning’]Разность между действительным потенциалом электрода при электролизе и нормальным для него потенциалом называют перенапряжением. Оно увеличивает потери энергии при электролизе.[/stextbox]
С другой стороны, увеличивая перенапряжение для ионов водорода, можно затруднить его выделение на катоде, что позволяет получить электролизом из водных растворов ряд таких более отрицательных по сравнению с водородом металлов, как свинец, олово, никель, кобальт, хром и даже цинк. Это достигается ведением процесса при повышенных плотностях тока на электродах, а также введением в электролит некоторых веществ.
Течение катодных и анодных реакций при электролизе определяется следующими двумя законами Фарадея.
Масса вещества mэ, выделившегося при электролизе на катоде или перешедшего с анода в электролит, пропорциональна количеству прошедшего через электролит электричества Iτ: mэ = α/τ,здесь а – электрохимический эквивалент вещества, г/Кл.
Масса выделенного при электролизе вещества одним и тем же количеством электричества прямо пропорциональна атомной массе вещества А и обратно пропорциональна его валентности n: mэ = А / 96480n, здесь 96480 – число Фарадея, Кл х моль-1.
Интересно почитать: то такое датчик Холла.
Таким образом, электрохимический эквивалент вещества α= А / 96480n представляет собой массу вещества в граммах, выделяемую единицей проходящего через электролитическую ванну количества электричества – кулоном (ампер-секундой). Для меди А = 63,54, n =2, α =63,54/96480-2= 0,000329 г/Кл, для никеля α =0,000304 г/Кл, для цинка α=0,00034 г/Кл. В действительности масса выделившегося вещества всегда меньше указанной, что объясняется рядом побочных процессов, проходящих в ванне (например, выделением водорода на катоде), утечками тока и короткими замыканиями между электродами.
Теоретическая часть
Электролиз – совокупность окислительно-восстановительных реакций, протекающих под действием постоянного электрического тока на электродах, погруженных в раствор или расплав электролита. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне. Электролиз проводят в особых приборах – электролизерах. Это сосуд с раствором или расплавом электролита и опущенными в него электродами из металла или графита. К электродам прикладывают разность потенциалов от внешнего источника постоянного тока. Катод отдает электроны частицам вещества в электролите и восстанавливает их. Анод отбирает электроны от частиц в электролите, окисляя их.
При электролизе процессы окисления и восстановления протекают на различных электродах – аноде и катоде. Анод – это электрод, на котором происходит процесс окисления. При электролизе анод заряжен положительно. Катод – это электрод, на котором происходит процесс восстановления. При электролизе катод заряжен отрицательно. На окислительно-восстановительные процессы, протекающие при электролизе, влияют различные факторы:
- Природа электролита и растворителя;
- Материал электродов;
- Режим электролиза (напряжение, сила тока, температура).
Различают 2 типа электролиза: электролиз расплава и электролиз растворов электролитов. Электролиз расплавов оксидов На катоде идет восстановление катионов металла: Men++ nē = Me0 , т.е. на катоде выделяется металл. На аноде окисляется кислород: O –2 –2ē = O2 Например, электролиз расплава оксида калия: 2K2O = 4K + O2 При изучении алюминия, способов получения металлов, надо знать электролиз оксида алюминия. Металлический алюминий получают электролизом раствора глинозема Al2O3 в расплавленном криолите Na2AlF6 при 960–970°С. Электролиз Al2O3 можно представить следующей схемой: в расплаве оксид алюминия диссоциирует: Al2O3= Al3++ AlO3 3– , на катоде восстанавливаются ионы Al3+ : Al3++3ē Al0 , на аноде окисляются ионы AlO3 3– : 4AlO3 3– – 12ē 2Al2O3 + 3O2. Суммарное уравнение процесса: 2Al2O3 4Al + 3O2. Жидкий алюминий собирается на дне электролизера.
Электролиз расплавов оснований
На катоде традиционно восстанавливается металл: Men+ +nē = Me0 На аноде будет окисляться кислород в составе гидроксид-группы: 4OH− −4ē =2H2O + O2 Электролиз расплавов солей 1. Электролиз расплава бескислородной соли: На катоде всегда восстанавливается металл: Men + nē = Me0 На аноде окисляется бескислородный анион: A n– – nē = A0 Например: Электролиз расплава NaCl: 2NaCl = 2Na + Cl2 2.Электролиз расплава кислородсодержащей соли (элемент аниона находится не в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде будет окисляться элемент аниона: SO3 2– – 2ē = SO3 0 Например, электролиз расплава сульфита натрия: Na2SO3 = 2Na + SO3 Сера S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 (SO3). 3.
Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде: т.к. элемент уже в высшей степени окисления, то окисляться будет кислород, например: 2CO3 –2 – 4ē = 2CO2 + O2 Например, электролиз расплава карбоната натрия: 2Na2CO3 = 4Na + 2CO2+ O2 Важно понимать, что эти реакции не идут сами по себе. Их протекание возможно только при действии электрического тока. Электролиз растворов На катоде могут протекать следующие реакции восстановления.
Катодные процессы: Li K Ca Na Mg Al Li+K +Ca2+Na+Mg2+Al3+ Mn Zn Fe Ni Sn Pb Mn2+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ H2 2H+ Cu Hg Ag Pt Au Cu2+Hg2 2+Ag+ Pt2+Au3+ Восстанавливается вода: 2H2O+2ē=H2↑+2OH− ; M n+ не восстанавливается Восстанавливаются катионы металла и вода: Mn++nē=M0 2H2O+2ē=H2↑+2OH−Восстанавливаются катионы металла: M n++ nē=М0 а) при электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений после водорода, происходит выделение металлов на катоде: (-) Cu2++ 2ē → Cu. б) при электролизе растворов солей, содержащих катионы, расположенные между алюминием и водородом, на катоде могут протекать конкурирующие процессы как восстановления катионов, так и выделения водорода: (-) Zn2++ 2ē → Zn; (-) 2H2O + 2ē → H2↑ + 2OH– . в) если растворы солей содержат катионы, находящиеся в ряду напряжения до алюминия, то в водном растворе такие ионы восстановленными быть не могут, на катоде выделяется водород: (-) 2H2O + 2ē → H2↑ + 2OH– . Процесс на аноде зависит от материала анода и от природы аниона. На аноде протекают реакции окисления.
Заключение
Более подробно об электролизе рассказано в статье ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ И РАСПЛАВОВ СОЛЕЙ. А также в нашей группе ВК можно задавать вопросы и получать на них подробные ответы от профессионалов. Для этого приглашаем читателей подписаться и вступить в группу. В завершение статьи хочу выразить благодарность источникам, откуда мы черпали информацию во время подготовки материала:
www.fizika.ru
www.ksma.ru
www.elektro.guru
www.prosto-o-slognom.ru
www.electricalschool.info
www.elektrovesti.net
Предыдущая