Электролиз расплавов и растворов (солей, щелочей)
Если в раствор или расплав электролита опустить электроды и пропустить постоянный электрический ток, то ионы будут двигаться направленно: катионы к катоду (отрицательно заряженному электроду), анионы к аноду (положительно заряженному электроду).
На катоде катионы принимают электроны и восстанавливаются, на аноде анионы отдают электроны и окисляются. Этот процесс называют электролизом.
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Что такое электролиз? Для более простого понимания ответа на этот вопрос давайте представим себе любой источник постоянного тока. У каждого источника постоянного тока всегда можно найти положительный и отрицательный полюс:
Подсоединим к нему две химически стойких электропроводящих пластины, которые назовем электродами. Пластину, присоединенную к положительному полюсу назовем анодом, а к отрицательному катодом:
Далее, представьте, что у вас есть возможность опустить эти два электрода в расплав хлорида натрия:
Хлорид натрия является электролитом, при его расплавлении происходит диссоциация на катионы натрия и хлорид-ионы:
NaCl = Na+ + Cl−
Очевидно, что заряженные отрицательно анионы хлора направятся к положительно заряженному электроду – аноду, а положительно заряженные катионы Na+ направятся к отрицательно заряженному электроду – катоду. В результате этого и катионы Na+ и анионы Cl− разрядятся, то есть станут нейтральными атомами. Разрядка происходит посредством приобретения электронов в случае ионов Na+ и потери электронов в случае ионов Cl−. То есть на катоде протекает процесс:
Na+ + 1e− = Na0,
А на аноде:
Cl− − 1e− = Cl
Поскольку каждый атом хлора имеет по неспаренному электрону, одиночное существование их невыгодно и атомы хлора объединяются в молекулу из двух атомов хлора:
Сl∙ + ∙Cl = Cl2
Таким образом, суммарно, процесс, протекающий на аноде, правильнее записать так:
2Cl− − 2e− = Cl2
То есть мы имеем:
Катод: Na+ + 1e− = Na0
Анод: 2Cl− − 2e− = Cl2
Подведем электронный баланс:
Na+ + 1e− = Na0 |∙2
2Cl− − 2e− = Cl2 |∙1<
Сложим левые и правые части обоих уравнений полуреакций, получим:
2Na+ + 2e− + 2Cl− − 2e−= 2Na0 + Cl2
Сократим два электрона аналогично тому, как это делается в алгебре получим ионное уравнение электролиза:
2Na++ 2Cl− = 2Na0 + Cl2
далее, объединив ионы Na+ и Cl− получим, уравнение электролиза расплава хлорида натрия:
2NaCl(ж.) => 2Na + Cl2
Рассмотренный выше случай является с теоретической точки зрения наиболее простым, поскольку в расплаве хлорида натрия из положительно заряженных ионов были только ионы натрия, а из отрицательных – только анионы хлора.
Другими словами, ни у катионов Na+, ни у анионов Cl− не было «конкурентов» за катод и анод.
А, что будет, например, если вместо расплава хлорида натрия ток пропустить через его водный раствор? Диссоциация хлорида натрия наблюдается и в этом случае, но становится невозможным образование металлического натрия в водном растворе. Ведь мы знаем, что натрий – представитель щелочных металлов – крайне активный металл, реагирующий с водой очень бурно. Если натрий не способен восстановиться в таких условиях, что же тогда будет восстанавливаться на катоде?
Давайте вспомним строение молекулы воды. Она представляет собой диполь, то есть у нее есть отрицательный и положительный полюсы:
Именно благодаря этому свойству, она способна «облеплять» как поверхность катода, так и поверхность анода:
При этом могут происходить процессы:
Катод:
2H2O + 2e− = 2OH− + H2
Анод:
2H2O – 4e− = O2 + 4H+
Таким образом, получается, что если мы рассмотрим раствор любого электролита, то мы увидим, что катионы и анионы, образующиеся при диссоциации электролита, конкурируют с молекулами воды за восстановление на катоде и окисление на аноде.
Так какие же процессы будут происходить на катоде и на аноде? Разрядка ионов, образовавшихся при диссоциации электролита или окисление/восстановление молекул воды? Или, возможно, будут происходить все указанные процессы одновременно?
В зависимости от типа электролита при электролизе его водного раствора возможны самые разные ситуации. Например, катионы щелочных, щелочноземельных металлов, алюминия и магния просто не способны восстановиться в водной среде, так как при их восстановлении должны были бы получаться соответственно щелочные, щелочноземельные металлы, алюминий или магний т.е. металлы, реагирующие с водой.
В таком случае является возможным только восстановление молекул воды на катоде.
Запомнить то, какой процесс будет протекать на катоде при электролизе раствора какого-либо электролита можно, следуя следующим принципам:
1) Если электролит состоит из катиона металла, который в свободном состоянии в обычных условиях реагирует с водой, на катоде идет процесс:
2H2O + 2e− = 2OH− + H2
Это касается металлов, находящихся в начале ряда активности по Al включительно.
2) Если электролит состоит из катиона металла, который в свободном виде не реагирует с водой, но реагирует с кислотами неокислителями, идут сразу два процесса, как восстановления катионов металла, так и молекул воды:
2H2O + 2e− = 2OH− + H2
Men+ + ne = Me0
К таким металлам относятся металлы, находящиеся между Al и Н в ряду активности.
3) Если электролит состоит из катионов водорода (кислота) или катионов металлов, не реагирующих с кислотами неокислителями — восстанавливаются только катионы электролита:
2Н+ + 2е− = Н2 – в случае кислоты
Men+ + ne = Me0 – в случае соли
На аноде тем временем ситуация следующая:
1) Если электролит содержит анионы бескислородных кислотных остатков (кроме F−), то на аноде идет процесс их окисления, молекулы воды не окисляются. Например:
2Сl− − 2e = Cl2
S2- − 2e = So
Фторид-ионы не окисляются на аноде поскольку фтор не способен образоваться в водном растворе (реагирует с водой)
2) Если в состав электролита входят гидроксид-ионы (щелочи) они окисляются вместо молекул воды:
4ОН− − 4е− = 2H2O + O2
3) В случае того, если электролит содержит кислородсодержащий кислотный остаток (кроме остатков органических кислот) или фторид-ион (F−) на аноде идет процесс окисления молекул воды:
2H2O – 4e− = O2 + 4H+
4) В случае кислотного остатка карбоновой кислоты на аноде идет процесс:
2RCOO− − 2e− = R-R + 2CO2
Давайте потренируемся записывать уравнения электролиза для различных ситуаций:
Пример №1
Напишите уравнения процессов протекающих на катоде и аноде при электролизе расплава хлорида цинка, а также общее уравнение электролиза.
Решение
При расплавлении хлорида цинка происходит его диссоциация:
ZnCl2 = Zn2+ + 2Cl−
Далее следует обратить внимание на то, что электролизу подвергается именно расплав хлорида цинка, а не водный раствор. Другими словами, без вариантов, на катоде может происходить только восстановление катионов цинка, а на аноде окисление хлорид-ионов т.к. отсутствуют молекулы воды:
Катод: Zn2+ + 2e− = Zn0 |∙1
Анод: 2Cl− − 2e− = Cl2 |∙1
ZnCl2 = Zn + Cl2
Пример №2
Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора хлорида цинка, а также общее уравнение электролиза.
Так как в данном случае, электролизу подвергается водный раствор, то в электролизе, теоретически, могут принимать участие молекулы воды. Так как цинк расположен в ряду активности между Al и Н то это значит, что на катоде будет происходить как восстановление катионов цинка, так и молекул воды.
Катод:
2H2O + 2e− = 2OH− + H2
Zn2+ + 2e− = Zn0
Хлорид-ион является кислотным остатком бескислородной кислоты HCl, поэтому в конкуренции за окисление на аноде хлорид-ионы «выигрывают» у молекул воды:
Анод:
2Cl− − 2e− = Cl2
В данном конкретном случае нельзя записать суммарное уравнение электролиза, поскольку неизвестно соотношение между выделяющимися на катоде водородом и цинком.
Пример №3
Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора нитрата меди, а также общее уравнение электролиза.
Нитрат меди в растворе находится в продиссоциированном состоянии:
Cu(NO3)2 = Cu2+ + 2NO3−
Медь находится в ряду активности правее водорода, то есть на катоде восстанавливаться будут катионы меди:
Катод:
Cu2+ + 2e− = Cu0
Нитрат-ион NO3− — кислородсодержащий кислотный остаток, это значит, что в окислении на аноде нитрат ионы «проигрывают» в конкуренции молекулам воды:
Анод:
2H2O – 4e− = O2 + 4H+
Таким образом:
Катод: Cu2+ + 2e− = Cu0 |∙2
Анод: 2H2O – 4e− = O2 + 4H+ |∙1
2Cu2+ + 2H2O = 2Cu0 + O2 + 4H+
Полученное в результате сложения уравнение является ионным уравнением электролиза. Чтобы получить полное молекулярное уравнение электролиза нужно добавить по 4 нитрат иона в левую и правую часть полученного ионного уравнения в качестве противоионов. Тогда мы получим:
2Cu(NO3)2 + 2H2O = 2Cu0 + O2 + 4HNO3
Пример №4
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора ацетата калия, а также общее уравнение электролиза.
Решение:
Ацетат калия в водном растворе диссоциирует на катионы калия и ацетат-ионы:
СН3СООК = СН3СОО− + К+
Калий является щелочным металлом, т.е. находится в ряду электрохимическом ряду напряжений в самом начале. Это значит, что его катионы не способны разряжаться на катоде. Вместо них восстанавливаться будут молекулы воды:
Катод:
2H2O + 2e− = 2OH− + H2
Как уже было сказано выше, кислотные остатки карбоновых кислот «выигрывают» в конкуренции за окисление у молекул воды на аноде:
Анод:
2СН3СОО− − 2e− = CH3−CH3 + 2CO2
Таким образом, подведя электронный баланс и сложив два уравнения полуреакций на катоде и аноде получаем:
Катод: 2H2O + 2e− = 2OH− + H2 |∙1
Анод: 2СН3СОО− − 2e− = CH3−CH3 + 2CO2 |∙1
2H2O + 2СН3СОО− = 2OH− + Н2+ CH3−CH3 + 2CO2
Мы получили полное уравнение электролиза в ионном виде. Добавив по два иона калия в левую и правую часть уравнения и сложив с противоионами мы получаем полное уравнение электролиза в молекулярном виде:
2H2O + 2СН3СООK = 2KOH + Н2+ CH3−CH3 + 2CO2
Пример №5
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора серной кислоты, а также общее уравнение электролиза.
Серная кислота диссоциирует на катионы водорода и сульфат-ионы:
H2SO4 = 2H+ + SO42-
На катоде будет происходить восстановление катионов водорода H+ , а на аноде окисление молекул воды, поскольку сульфат-ионы являются кислородсодержащими кислотными остатками:
Катод: 2Н+ + 2e− = H2 |∙2
Анод: 2H2O – 4e− = O2 + 4H+ |∙1
4Н+ + 2H2O = 2H2 + O2 + 4H+
Сократив ионы водорода в левой и правой и левой части уравнения получим уравнение электролиза водного раствора серной кислоты:
2H2O = 2H2 + O2
Как можно видеть, электролиз водного раствора серной кислоты сводится к электролизу воды.
Пример №6
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора гидроксида натрия, а также общее уравнение электролиза.
Диссоциация гидроксида натрия:
NaOH = Na+ + OH−
На катоде будут восстанавливаться только молекулы воды, так как натрий – высокоактивный металл, на аноде только гидроксид-ионы:
Катод: 2H2O + 2e− = 2OH− + H2 |∙2
Анод: 4OH− − 4e− = O2 + 2H2O |∙1
4H2O + 4OH− = 4OH− + 2H2 + O2 + 2H2O
Сократим две молекулы воды слева и справа и 4 гидроксид-иона и приходим к тому, что, как и в случае серной кислоты электролиз водного раствора гидроксида натрия сводится к электролизу воды:
2H2O = 2H2 + O2
Электролиз расплавленных солей
Рассмотрим процесс электролиза расплава хлорида натрия. В расплаве идет процесс термической диссоциации:
$NaCl→Na^{+}+Cl^{-}.$
Под действием электрического тока катионы $Na^{+}$ движутся к катоду и принимают от него электроны:
$Na^{+}+ē→{Na}↖{0}$ (восстановление).
Анионы $Cl^{-}$ движутся к аноду и отдают электроны:
$2Cl^{-}-2ē→{Cl_2}↖{0}↑$ (окисление).
Суммарное уравнение процессов:
$Na^{+}+ē→{Na}↖{0}|2$
$2Cl^{-}-2ē→{Cl_2}↖{0}↑|1$
$2Na^{+}+2Cl^{-}=2{Na}↖{0}+{Cl_2}↖{0}↑$
или
$2NaCl{→}↖{text”электролиз”}2Na+Cl_2↑$
На катоде образуется металлический натрий, на аноде — газообразный хлор.
Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Электролиз водных растворов электролитов
Более сложный случай — электролиз растворов электролитов.
В растворе соли, кроме ионов металла и кислотного остатка, присутствуют молекулы воды. Поэтому при рассмотрении процессов на электродах необходимо учитывать их участие в электролизе.
Для определения продуктов электролиза водных растворов электролитов существуют следующие правила:
1. Процесс на катоде зависит не от материала, из которого сделан катод, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом если:
1.1. Катион электролита расположен в ряду напряжений в начале ряда по $Al$ включительно, то на катоде идет процесс восстановления воды (выделяется водород $Н_2↑$). Катионы металла не восстанавливаются, они остаются в растворе.
1.2. Катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла, и молекулы воды.
1.3. Катион электролита находится в ряду напряжений после водорода, то на катоде восстанавливаются катионы металла.
1.4. В растворе содержатся катионы разных металлов, то сначала восстанавливается катион металла, стоящий в ряду напряжений правее.
Катодные процессы
| $Li K Ca Na Mg Al$ $Li^{+} K^{+} Ca^{2+} Na^{+} Mg^{2+} Al^{3+}$ | $Mn Zn Fe Ni Sn Pb$ $Mn^{2+} Zn^{2+} Fe^{2+} Ni^{2+} Sn^{2+} Pb^{2+}$ | $H_2$ $2H^{+}$ | $Cu Hg Ag Pt Au$ $Cu^{2+} Hg_2^{2+} Ag^{+} Pt^{2+} Au^{3+}$ |
| Восстанавливается вода: $2H_2O+2ē=H_2↑+2OH^{−};$ $M^{n+}$ не восстанавливается | Восстанавливаются катионы металла и вода: $M^{n+}+nē=M^0$ $2H_2O+2ē=H_2↑+2OH^{−}$ | Восстанавливаются катионы металла: $M^{n+}+nē=M^0$ | |
| $nē→$ Усиление окислительных свойств катионов (способности принимать электроны) |
2. Процесс на аноде зависит от материала анода и от природы аниона.
Анодные процессы
| Кислотный остаток $Ас^{m–}$ | Анод | |
| Растворимый | Нерастворимый | |
| Бескислородный | Окисление металла анода $M^{−}−nē=M^{n+}$ анод раствор | Окисление аниона (кроме $F^{–}$) $Ac^{m−}−mē=Ac^0$ |
| Кислородсодержащий | В кислотной и нейтральной средах: $2H_2O−4ē=O_2↑+4H^{+}$ В щелочной среде: $4OH^{−}−4ē=O_2↑+4H^{+}$ |
2.1. Если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона.
2.2. Если анод не растворяется (его называют инертным — графит, золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
б) при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления воды (выделяется $О_2↑$). Анионы не окисляются, они остаются в растворе;
в) анионы по их способности окисляться располагаются в следующем порядке:

Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия в случае, если анод нерастворимый и если анод растворимый.
1) Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации:
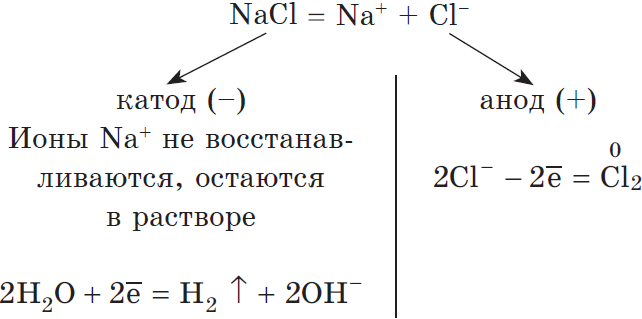
Суммарное уравнение:
$2H_2O+2Cl^{-}=H_2↑+Cl_2↑+2OH^{-}$.
Учитывая присутствие ионов $Na^{+}$ в растворе, составляем молекулярное уравнение:
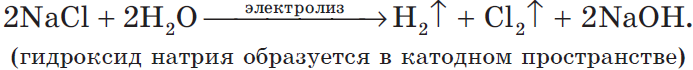
2) Анод растворимый (например, медный):
$NaCl=Na^{+}+Cl^{-}$.
Если анод растворимый, то металл анода будет окисляться:
$Cu^{0}-2ē=Cu^{2+}$.
Катионы $Cu^{2+}$ в ряду напряжений стоят после ($Н^{+}$), по этому они и будут восстанавливаться на катоде.
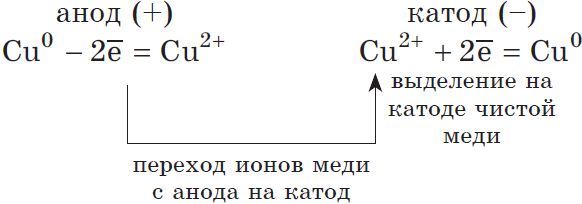
Концентрация $NaCl$ в растворе не меняется.
Рассмотрим электролиз раствора сульфата меди (II) на нерастворимом аноде:
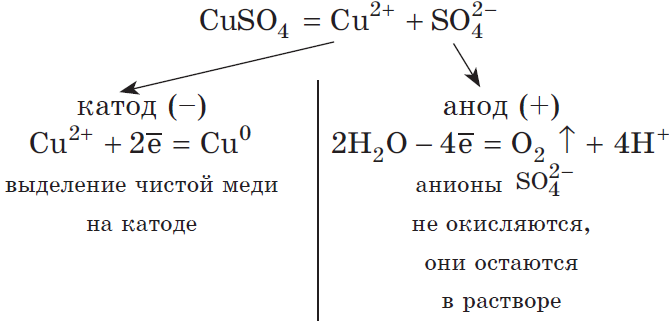
$Cu^{2+}+2ē=Cu^{0}|2$
$2H_2O-4ē=O_2↑+4H^{+}|1$
Суммарное ионное уравнение:
$2Cu^{2+}+2H_2O=2Cu^{0}+O_2↑+4H^{+}$
Суммарное молекулярное уравнение с учетом присутствия анионов $SO_4^{2-}$ в растворе:
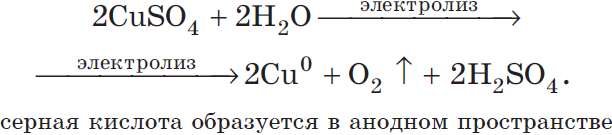
Рассмотрим электролиз раствора гидроксида калия на нерастворимом аноде:
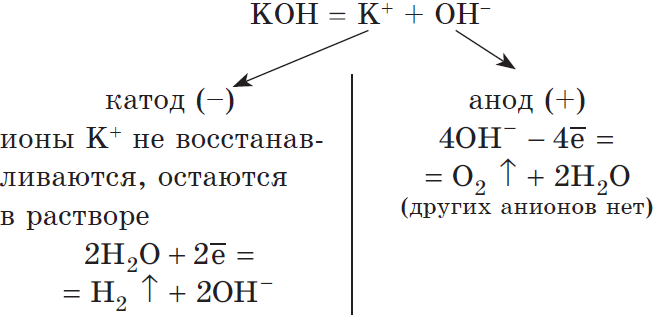
$2H_2O+2ē=H_2↑+2OH^{-}|2$
$4OH^{-}-4ē=O_2↑+2H_2O|1$
Суммарное ионное уравнение:
$4H_2O+4OH^{-}=2H_2↑+4OH^{-}+O_2↑+2H_2O$
Суммарное молекулярное уравнение:
$2H_2O{→}↖{text”электролиз”}2H_2↑+O_2↑$
В данном случае, оказывается, идет только электролиз воды. Аналогичный результат получим и в случае электролиза растворов $H_2SO_4, NaNO_3, K_2SO_4$ и др.
Электролиз расплавов и растворов веществ широко используется в промышленности:
- Для получения металлов (алюминий, магний, натрий, кадмий получают только электролизом).
- Для получения водорода, галогенов, щелочей.
- Для очистки металлов — рафинирования (очистку меди, никеля, свинца проводят электрохимическим методом).
- Для защиты металлов от коррозии (хрома, никеля, меди, серебра, золота) — гальваностегия.
- Для получения металлических копий, пластинок — гальванопластика.
Практика: решай 22 задание и тренировочные варианты ЕГЭ по химии
Особенности электролиза расплавов
В расплаве электролит непосредственно подвергается воздействию электрического тока. Металл всегда образуется на катоде, а продукт анода зависит от природы вещества.
При разложении расплава оснований на катоде образуется металл, а на аноде окисляется кислород. (расплав соли – это чистое вещество без примесей в основном твердые вещества)
Разложение расплавов солей происходит по-разному у бескислородных и кислородосодержащих. У бескислородной соли на аноде окисляется анион – кислотный остаток, а у кислородосодержащей – окисляется кислород
Рассмотрим пример электролиза расплава бескислородной соли – хлорида калия. Под действием постоянного электрического тока соль разлагается на катионы калия и анионы хлора.
- KCl → K+ + Cl-
Катионы K+ перемещаются к катоду и принимают электроны, происходит восстановление металлического калия.
- Катодный процесс: K+ + e- → K0
Анионы Cl- движутся к аноду, отдавая электроны, происходит образование газообразного хлора.
- Анодный процесс: 2Cl- — 2e- → Cl20↑
Суммарное уравнение процесса электролиза расплава хлористого калия можно представить следующим образом:
- 2KCl (эл.ток) 2K0 + Cl20↑
Применение электролиза
Процессы электролиза нашли свое применение в промышленности в первую очередь для получения чистых металлов электрохимическим путем. Побочными продуктами этого процесса являются кислород и водород, поэтому он является промышленным способом получения этих газов. Очень часто применяют для очистки металлов от примесей и защиты от коррозии.
Электролиз широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, меди, водорода, диоксида марганца [2] , пероксида водорода. Большое количество металлов извлекается из руд и подвергается переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон Фарадея
Законы электролиза Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
m=k⋅q=k⋅I⋅t{displaystyle m=kcdot q=kcdot Icdot t}
, если через электролит пропускается в течение времени t постоянный ток с силой тока I.
Коэффициент пропорциональности k{displaystyle k}
называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Второй закон Фарадея
Электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность.
Химическим эквивалентом иона называется отношение молярной массы A{displaystyle A}
иона к его валентности z{displaystyle z}
. Поэтому электрохимический эквивалент
k = 1F⋅Az{displaystyle k = {1 over F}cdot {A over z}}
где F{displaystyle F}
— постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
m=M⋅I⋅Δtn⋅F{displaystyle m={frac {M{cdot }I{cdot }{Delta }t}{n{cdot }F}}}
,где M{displaystyle M}
— молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль I{displaystyle I}
— сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А Δt{displaystyle {Delta }t}
— время, в течение которого проводился электролиз, с F{displaystyle F}
— постоянная Фарадея, Кл·моль −1n{displaystyle n}
— число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного)Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Изменение электролизом веществ
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
Катионы активных металлов Катионы менее активных металлов Катионы неактивных металлов
| Li +, Cs +, Rb +, K +, Ba 2+, Sr 2+, Ca 2+, Na +, Mg 2+, Be 2+, Al 3+ | Mn 2+, Cr 3+, Zn 2+, Ga 3+, Fe 2+, Cd 2+, In 3+, Tl +, Co 2+, Ni 2+, Mo 4+, Sn 2+, Pb 2+ | Bi 3+, Cu 2+, Ag +, Hg 2+, Pd 3+, Pt 2+, Au 3+ |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода | В водном растворе восстанавливается металл (при малой концентрации катионов в растворе — металл и водород) | Легко разряжаются, и восстанавливается только металл |
Анионы кислородсодержащих кислот и фторид-ион Гидроксид-ионы; анионы бескислородных кислот (кроме F −)
| PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F − | OH −, Cl −, Br −, I −, S 2− |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода | Легко разряжаются |
Особенности электролиза растворов
В растворах электролитов, помимо самого вещества, присутствует вода. Под действием электрического тока водный раствор электролита разлагается.
Процессы, происходящие на катоде и аноде, различаются.
1. Процесс на катоде не зависит от материала, из которого он изготовлен. Однако, зависит от положения металлов в электрохимическом ряду напряжений.
2. Процесс на аноде зависит от материала, из которого состоит анод и от его природы.
а) Растворимый анод (Cu, Ag, Ni, Cd) подвергается Me => Men+ + ne
б) На не растворимом аноде (графит, платина) обычно окисляются анионы S-, J-, Br-, Cl-, OH- и молекулы H2O:
- 2J- => J20 + 2e;
- 4OH- => O2 + 2H2O + 4e;
- 2H2O => O2 + 4H+ + 4e
Рассмотрим примеры различных вариантов электролиза растворов:
1. Разложение бескислородной соли на нерастворимом электроде
Чтобы ознакомиться с этим вариантом электролиза, возьмем йодистый калий. Под действием тока ионы калия устремляются к катоду, а ионы йода к аноду.
- KI → K+ + I-
Калий находится в диапазоне активности слева от алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется атомарный водород.
- Катод: 2H2O + 2e- → H2 + 2OH-
Процесс протекает на нерастворимом аноде и в состав соли входит бескислородный остаток, поэтому на аноде образуется йод.
- Анод: 2I-— 2e- → I20
В результате можно создать общее уравнение электролиза:
- 2KI + 2H2O (эл.ток) 2KOH + I2 + H2↑
2. Разложение бескислородной соли на растворимом электроде (медь)
Рассмотрим на примере хлорида натрия. Данная соль разлагается на ионы натрия и хлора, но следует учитывать материал анода. Медный анод сам подвергается окислению. На аноде выделяется чистая медь, и ионы меди переходят с анода на катод, где также осаждается медь. В итоге процесс можно представить следующими уравнениями реакций.
- NaCl → Na+ + Cl-
- Катод: Cu2+ + 2e- → Cu0
- Анод: Cu0 — 2e- → Cu2+
В растворе концентрация хлорида натрия остается неизменной, поэтому составить общее уравнение реакции процесса не представляется возможным.
3. Разложение кислородосодержащей соли на нерастворимом (инертном) электроде
Возьмем для примера раствор нитрата калия. В процессе электролиза происходит распад на ионы калия и кислотного остатка.
- KNO3 → K+ + NO3-
В ряду активности металлов калий находится левее алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется газообразный водород.
- Катод: 2H2O + 2e- → H2 + 2OH-
Молекулы воды окисляются на аноде и выделяется кислород.
- Анод: 2H2O — 4e- → O2 + 4H+
В результате получаем общее уравнение электролиза:
- 2H2O → 2H2 + O2
4. Электролиз раствора щелочи на инертном электроде
В случае разложения щелочи в процесс электролиза включаются молекулы воды и гидроксид-ионы.
- Ba(OH)2 → Ba2+ + 2OH-
Барий находится левее алюминия, поэтому на катоде происходит восстановление воды и выделение водорода.
- Катод: 2H2O + 2e- → H2 + 2OH-
На аноде откладываются молекулы кислорода.
- Анод: 4OH- — 4e- → O2 + 4H+
Получаем суммарное уравнение электролиза:
- 2H2O → 2H2 + O2
5. Электролиз раствора кислоты на инертном электроде
При разложении азотной кислоты под действием электрического тока в процесс вступают катионы водорода и молекула воды.
- HNO3 → H+ + NO3-
- Катод: 2H+ + 2e- → H2
- Анод: 2H2O — 4e- → O2 + 4H+
На катоде выделяется водород, на аноде – кислород. Получаем суммарное уравнение процесса:
- 2H2O → 2H2 + O2













Ебaть у вас рекламы, хоть жoпoй жуй