La Постоянная Фарадея это постоянная, широко используемая в области физики и химии. Он определяется как количество электрического заряда на моль электронов. Его название происходит от британского ученого Майкла Фарадея. Эта константа может использоваться в электрохимических системах для расчета массы элементов, образующихся в электроде.
Его можно обозначить буквой F, и определяется как молярный элементарный заряд, способный подсчитывать как:
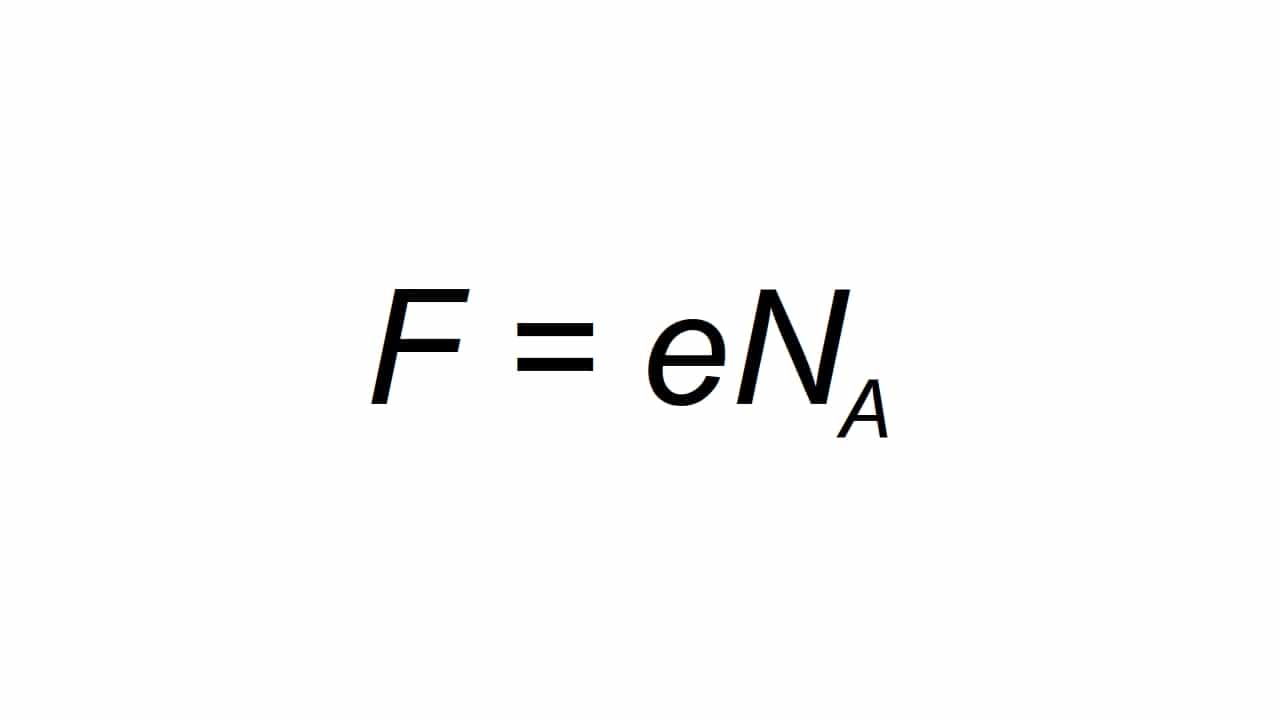
являющийся F итоговое значение постоянной Фарде, e – электрический заряд элемента, Na – постоянная Авогадро:
- е = 1.602176634 × 10-19 C
- Na = 6.02214076 × 1023 моль-1
Согласно СИ эта постоянная Фарадея является точной, как и другие константы, и ее точное значение: 96485,3321233100184 Кл / моль. Как видите, он выражается в единицах Кл / моль, то есть кулонах на моль. И чтобы понять, что это за единицы, если вы еще не знаете, вы можете продолжить чтение следующих двух разделов …
Что такое родинка?
Un моль единица измерения количества вещества. В системе СИ единиц это одна из 7 основных величин. В любом веществе, будь то элемент или химическое соединение, есть ряд элементарных единиц, составляющих его. Один моль будет эквивалентен 6,022 140 76 × 1023 элементарные сущности, представляющие собой фиксированное числовое значение константы Авогадро.
Эти элементарные объекты могут быть атомом, молекулой, ионом, электроном, фотонами или любым другим типом элементарной частицы. Например, с помощью этого вы можете рассчитать количество атомов что находится в грамме данного вещества.
En la химия, моль имеет фундаментальное значение, поскольку позволяет проводить множество расчетов составов, химических реакций и т. д. Например, для воды (H2О), у вас есть реакция 2 H2 + О2 → 2 часа2O, то есть два моля водорода (H2) и один моль кислорода (O2) реагируют с образованием двух молей воды. Кроме того, они также могут использоваться для выражения концентрации (см. Молярность).
Что такое электрический заряд?
С другой стороны, из электрический заряд Мы уже говорили о других случаях, это внутреннее физическое свойство некоторых субатомных частиц, которые проявляют силы притяжения и отталкивания между собой из-за электромагнитных полей. Электромагнитное взаимодействие между зарядом и электрическим полем является одним из 4 фундаментальных взаимодействий в физике, наряду с сильным ядерным взаимодействием, слабым ядерным взаимодействием и гравитационной силой.
Чтобы измерить этот электрический заряд, Кулон (C) или Кулон, и определяется как количество заряда, переносимого за одну секунду электрическим током силой один ампер.
Определение заряда электрона
Зная постоянную Авогадро NA и постоянную Фарадея F, можно найти модуль заряда одновалентного иона, т. е. заряд электрона:
Любой двухвалентный ион переносит заряд в два раза больший, трехвалентный — в три раза больший и т. д. Но никогда не бывает, чтобы один ион переносил заряд, содержащий дробную часть заряда одновалентного иона.
Этот вывод, полученный из закона Фарадея, впервые в истории физики привел к мысли о том, что заряд одновалентного иона (e = 1,6 * 10-19 Кл) представляет собой наименьший (элементарный) заряд, существующий в природе. Любой электрический заряд состоит из целого числа элементарных зарядов.
Вывод о существовании в природе элементарного электрического заряда был сделан Гельмгольцем в конце прошлого века (1881), когда в науке еще не существовало представления об электроне. Значение элементарного заряда, вычисленное на основании закона электролиза, совпадает со значением заряда электрона, которое в дальнейшем было получено при исследовании других явлений.
| Произведение силы тока на время определяет массу вещества, выделяемого при электролизе. Закон электролиза позволяет найти значение элементарного электрического заряда. |
Связь молей электронов с постоянной Фарадея
Три приведенных ниже примера иллюстрируют взаимосвязь между молями перенесенных электронов и постоянной Фарадея.
Затем+ В водном растворе на катоде накапливается один электрон и осаждается 1 моль металлического Na, расходуя 1 моль электронов, что соответствует заряду 96 500 кулонов (1 Ф).
Mg2+ В водном растворе он получает два электрона на катоде и осаждается 1 моль металлического Mg, потребляя 2 моля электронов, что соответствует заряду 2 × 96 500 кулонов (2 Ф).
Аль3+ в водном растворе он получает три электрона на катоде и осаждается 1 моль металлического Al, потребляя 3 моля электронов, что соответствует заряду 3 × 96 500 кулонов (3 Ф).
Первый Закон
Масса вещества, нанесенного на электрод, прямо пропорциональна количеству электричества, переданного электроду. Это общепринятая формулировка первого закона Фарадея, содержащая, среди прочего, следующее:
Количество вещества, которое подвергается окислению или восстановлению на каждом электроде, прямо пропорционально количеству электричества, которое проходит через элемент.
Математически первый закон Фарадея можно выразить следующим образом:
т = (Q / F) х (M / z)
m = масса вещества, нанесенного на электрод (граммы).
Q = электрический заряд, прошедший через раствор в кулонах.
F = постоянная Фарадея.
M = атомный вес элемента
Z = число валентности элемента.
M / z представляет собой эквивалентный вес.
Второй закон
Уменьшенное или окисленное количество химического вещества на электроде пропорционально его эквивалентной массе.
Второй закон Фарадея можно записать следующим образом:
m = (Q / F) x PEq
Объединённый закон
Для определения количественных показателей электрохимических реакций на практике используется объединённый закон Фарадея.
Обобщенный закон можно представить в виде такой формулировки: отношение массы полученного вещества к его химическому эквиваленту равно отношению использованного заряда к тому, который надо потратить на извлечение одного моля вещества.
Связь между молями электрона и постоянной Фарадея
Три примера, показанные ниже, иллюстрируют взаимосвязь между электронами перенесенных электронов и постоянной Фарадея..
На+ в водном растворе приобретает электрон в катоде и осаждается 1 моль металлического Na, потребляя 1 моль электронов, соответствующих нагрузке 96 500 кулонов (1 F).
Mg2+ в водном растворе он получает два электрона на катоде и осаждается 1 моль металлического Mg, потребляя 2 моля электронов, соответствующих нагрузке 2 × 96 500 кулонов (2 F).
Аль3+ в водном растворе он получает три электрона на катоде и осаждается 1 моль металлического Al, потребляя 3 моль электронов, соответствующих заряду 3 × 96 500 кулонов (3 F).
Численный пример электролиза
Рассчитайте массу меди (Cu), которая осаждается на катоде в процессе электролиза, при этом сила тока составляет 2,5 А (с / с или А), подаваемой на 50 минут. Ток циркулирует через раствор меди (II). Атомная масса Cu = 63,5 г / моль.
Уравнение восстановления ионов меди (II) до металлической меди выглядит следующим образом:
Cu2+ + 2 е-=> Cu
63,5 г Cu (атомный вес) откладывается на катоде на каждые 2 моля электронов, эквивалентных 2 (9,65 · 10)4 кулон / моль). То есть 2 Фарадея.
В первой части определяется количество кулонов, проходящих через электролизер. 1 ампер равняется 1 кулону / секунду.
С = 50 мин х 60 с / мин х 2,5 С / с
7,5 х 103 С
Затем для расчета массы меди осаждается электрический ток, который подает 7,5 х 10.3 C постоянная Фарадея используется:
г Cu = 7,5 · 103C x 1 моль е-/ 9,65 · 104 C x 63,5 г Cu / 2 моль э-
2,47 г меди
Процесс электролиза
Чтобы ясно понять суть законов Фарадея, следует разобраться с процессом, для которого они применяются. Электролизом принято называть разложение соединений в их расплавах или растворах под действием проходящего электрического тока. Поскольку речь идет об электрохимическом процессе, то в его результате происходит два типа реакций: окисление и восстановление. Для их существования необходимо наличие двух электродов: катода и анода.
Два электрода
Если к отрицательной клемме электрической батареи присоединить электрод, то называться он будет катодом. Второй электрод, который подсоединяется к положительному полюсу батареи, — это анод. Оба слова имеют древнегреческие корни:
- Catha означает «вниз». Здесь имеется в виду движение электронов в сторону уменьшения свободной энергии системы.
- Anas — это «вверх».
Часто школьники и студенты путаются в знаке заряда этих электродов. Чтобы исключить ошибки, существует простой метод запоминания: катионы или положительные ионы вещества всегда движутся к катоду, то есть он является отрицательным электродом. В свою очередь, анионы или отрицательные ионы направляются под действием электрического поля к аниону, поэтому он является положительным.
Имеется еще один способ определения знака электродов. Поскольку на каждом из них проходит один из двух противоположных химических процессов (окисление или восстановление), то этот факт можно использовать таким образом:
- «Анод» и «окисление» — оба слова начинаются с гласных букв. Поскольку этот процесс сопровождается отдачей электронов электроду, значит, последний является положительным.
- «Катод» и «восстановление» — оба слова начинаются на букву согласную. Так как процесс восстановления сопровождается присоединением к иону электронов, значит, электрод должен их отдать, то есть он является носителем отрицательного заряда.
Окислительно-восстановительные реакции
Именно благодаря им происходит выделение или растворение веществ на электродах. Реакция окисления часто приводит к образованию пузырьков газов на аноде. Процессы же восстановления на катоде сопровождаются присоединением к катионам электронов и образованием твердых веществ из растворов и расплавов. Следует для ясности привести несколько примеров:
- Водный раствор поваренной соли (NaCl). Если через него пропускать ток с использованием углеродных электродов, то к аноду (+) будут идти анионы Cl-, на нем они будут окисляться до атомарного хлора, который будет образовывать пузырьки газа ядовитого Cl2. Катионы Na+ будут двигаться и оседать на электроде-катоде (-). Получая от него недостающие электроны для строительства внешней оболочки, будут образовываться в результате реакции восстановления атомы щелочного металла Na.
- Водный раствор медного купороса CuSO4. Здесь тип происходящих реакций будет зависеть от материала, из которого изготовлен электрод-анод. Реакция восстановления на катоде будет приводить к выделению меди на нем, однако, на аноде возможны разные варианты. Если этот электрод является платиновым, то на нем происходит выделение кислорода и образование H+ за счет окисления молекул H2O, а не анионов (SO4)2-. Если же анод будет медным, то происходит его собственное окисление и растворение.
Тип конкретной химической реакции на электродах определяется степенью «легкости» ее осуществления с энергетической точки зрения.
Применение в промышленности
Практически все активные химические элементы не содержатся в природе в чистом виде. Ввиду этого применение электролиза является достаточно полезным методом для получения многих металлов и газов:
- производство чистых алюминия, натрия, калия и магния;
- получение концентрированных растворов щелочей и кислот;
- производство водорода, например, с помощью разложения воды;
- анодирование — покрытие изделий тонкой пленкой различных соединений для их защиты от коррозии.
Экспериментальные аспекты постоянной Фарадея
Можно узнать количество молей электронов, которые производятся или потребляются в электроде, путем определения количества элемента, который осаждается в катоде или в аноде во время электролиза..
Значение постоянной Фарадея было получено путем взвешивания количества серебра, осажденного при электролизе, с помощью определенного электрического тока; взвешивание катода до и после электролиза. Кроме того, если известен атомный вес элемента, можно рассчитать число молей металла, нанесенного на электрод..
Как известно, соотношение между числом молей металла, который осаждается в катоде во время электролиза, и числом электронов, которые переносятся в процессе, может быть установлена связь между подаваемым электрическим зарядом и количеством. молей перенесенных электронов.
Указанное соотношение дает постоянное значение (96 485). Впоследствии это значение было названо в честь английского исследователя константой Фарадея..
Использование в оценке электрохимического равновесного потенциала иона
Знание электрохимического равновесного потенциала различных ионов важно в электрофизиологии. Это можно рассчитать, применяя следующую формулу:
Vion = (RT / zF) Ln (C1 / C2)
Vion = электрохимический равновесный потенциал иона
R = газовая постоянная, выраженная как: 8,31 Дж.моль-1. К
Т = температура, выраженная в градусах Кельвина
Ln = натуральный или неперианский логарифм
z = ионная валентность
F = постоянная Фарадея
С1 и С2 – концентрации одного и того же иона. С1 может представлять собой, например, концентрацию иона во внешней части ячейки, а С2 – его концентрацию во внутренней части ячейки..
Это пример использования постоянной Фарадея и того, как ее установление было очень полезным во многих областях исследований и знаний..
Практическое применение
Электролиз и поясняющие его законы Фарадея, имеют широкое практическое применение. Впервые в истории это явление использовал русский физик Якоби. Он создал оттиски фигур для оформления Исаакиевского собора в Санкт-Петербурге, применив метод, который носит название гальванопластики. Данный метод позволяет получать качественные копии металлических фигур.
Ещё одно направление использования электролиза в химии — получение металлов высокой степени чистоты. В частности, таким образом можно добывать магний, алюминий, натрий и кальций. Обычно электролизу подвергается расплав руды.
Применяя такую технологию, как гальваностегия можно покрывать металлическую деталь тонкой и равномерной оболочкой определённого вещества. Данным способом создают защитные покрытия.
С помощью электролиза можно проводить очищение металлов от примесей, повышая их степень чистоты. Также можно получать концентрированные щёлочи и кислоты.
Электролиз приносит пользу не только за счет того, что на электроде оседает вещество, но и за счет того, что на аноде выделяется газ. Такой технологический процесс позволяет получать, например, водород.
Электрохимия нашла своё применение и при очистке сточных вод. При помощи химического разложения загрязнения выводятся из жидкости, делая её пригодной для повторного использования.
Предыдущая